Expansión
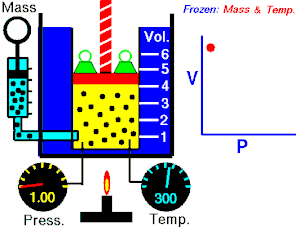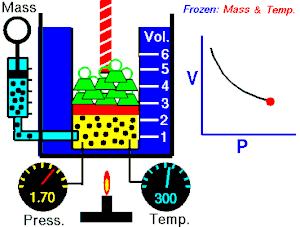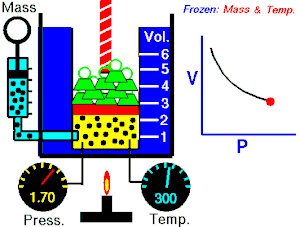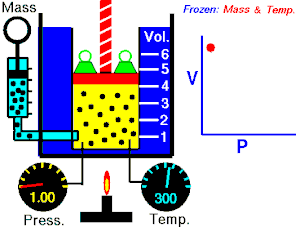
Se denomina proceso isotérmico o proceso isotermo al cambio reversible en un sistema termodinámico, siendo dicho cambio a temperatura constante en todo el sistema. La compresión o expansión de un gas ideal puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a la misma temperatura que el gas. este otro sistema se conoce como foco calórico. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.
Una curva isoterma es una línea que sobre un diagrama representa los valores sucesivos de las diversas variables de un sistema en un proceso isotermo. Las isotermas de un gas ideal en un diagrama P-V, llamado diagrama de Clapeyron, son hipérbolas equiláteras, cuya ecuación es P•V = constante.
Una expansión isotérmica es un proceso en el cual un gas se expande (o contrae), manteniendo la temperatura constante durante dicho proceso, es decir que T1 = T2 para los estados inicial (1) y final (2) del proceso isotérmico. Aplicando el primer principio de la termodinámica se obtiene:
Forma
Se denomina gas (palabra inventada por el científico flamenco Jan Baptista van Helmont en el siglo XVII, sobre el latín chaos) al estado de agregación de la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas interaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta energía cinética. Los gases son fluidos altamente compresibles, que experimentan grandes cambios de densidad con la presión y la temperatura. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven sus moléculas.
Los gases ocupan completamente el volumen del recipiente que los contiene.
Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
Volumen
El volumen es una magnitud escalar definida como la extensión en tres dimensiones de una región del espacio. Es una magnitud derivada de la longitud, ya que se halla multiplicando la longitud, el ancho y la altura. Desde un punto de vista físico, los cuerpos materiales ocupan un volumen por el hecho de ser extensos, fenómeno que se debe al principio de exclusión de Pauli.
Matemáticamente el volumen es definible no sólo en cualquier espacio euclídeo, sino también en otro tipo de espacios métricos que incluyen por ejemplo a las variedades de Riemann.
La unidad de medida de volumen en el Sistema Internacional de Unidades es el metro cúbico. Para medir la capacidad se utiliza el litro.
Comprensibilidad
La compresibilidad es una propiedad de la materia a la cual se debe que todos los cuerpos disminuyan de volumen al someterlos a una presión o compresión determinada manteniendo constantes otros parámetros.
En general para un sistema estable, la compresibilidad es un número positivo, lo que significa que cuando se aumenta la presión sobre el sistema, este disminuye su volumen. El caso contrario se puede observar en sistemas inestables por ejemplo en un sistema químico cuando la presión inicia una explosión. Los sólidos a nivel molecular son muy difíciles de comprimir, ya que las moléculas que tienen los sólidos están muy pegadas y existe poco espacio libre entre ellas como para acercarlas sin que aparezcan fuerzas de repulsión fuertes. Esta situación contrasta con la de los gases los cuales tienen sus moléculas muy separadas y que en general son altamente compresibles bajo condiciones de presión y temperatura normales. Los líquidos bajo condiciones de temperatura y presión normales son también bastante difíciles de comprimir aunque presenta una pequeña compresibilidad mayor que la de los sólidos.
En termodinámica se define la compresibilidad de un sistema termodinámico como el cambio relativo de volumen frente a una variación de la presión. En principio la magnitud de la compresibilidad depende de las condiciones bajo las cuales se lleva a cabo la compresión o descompresión del sistema, por lo que a menos que se especifique el modo en que se lleva a cabo esa operación la compresibilidad de un valor u otro según las cantidades de calor intercambiadas con el exterior. Debido a esa dependencia de la compresibilidad de las condiciones se distingue entre la compresibilidad isoterma y la compresibilidad adiabática.
Compresibilidad isoterma
Es una medida de la compresibilidad de un cuerpo o sistema termodinámico cuando se somete a un proceso termodinámico de transformación cuasiestática de presión mientras su temperatura se mantiene constante y uniforme, viene dada por:
En un proceso de variación de presión a temperatura constante, el cuerpo habrá intercambiado una cierta cantidad de calor con el exterior por lo que su energía total, que puede obtenerse como suma del trabajo realizado sobre el cuerpo y del calor intercambiado por el mismo no permanecerá constante.
Compresibilidad adiabática[editar]
Es una medida de la compresibilidad de un cuerpo o sistema termodinámico cuando se somete a una transformación cuasiestática de presión en condiciones de aislamiento térmico perfecto, viene dada por:
En un proceso adiabático de variación de presión, el cuerpo experimentará algún cambio de temperatura. Todos los fluidos son compresibles, incluyendo los líquidos. Cuando estos cambios de volumen son demasiado grandes se opta por considerar el flujo como compresible (que muestran una variación significativa de la densidad como resultado de fluir), esto sucede cuando la velocidad del flujo es cercano a la velocidad del sonido. Estos cambios suelen suceder principalmente en los gases ya que para alcanzar estas velocidades de flujo en líquidos, se precisa de presiones del orden de 1000 atmósferas, en cambio un gas sólo precisa una relación de presiones de 2:1 para alcanzar velocidades sónicas. La compresibilidad de un flujo es básicamente una medida en el cambio de la densidad. Los gases son en general muy compresibles, en cambio, la mayoría de los líquidos tienen una compresibilidad muy baja. Por ejemplo, una presión de 500 kPa provoca un cambio de densidad en el agua de solamente 0,024% (a temperatura ambiente). En cambio, esta misma presión aplicada al aire provoca un cambio de densidad de 250%. Por esto normalmente al estudio de los flujos compresibles se le conoce como dinámica de gases, siendo esta una nueva rama de la mecánica de fluidos, la cual describe estos flujos.
En un flujo usualmente hay cambios en la presión, asociados con cambios en la velocidad. En general, estos cambios de presión inducirán a cambios de densidad, los cuales influyen en el flujo, si estos cambios son importantes los cambios de temperatura presentados son apreciables. Aunque los cambios de densidad en un flujo pueden ser muy importantes hay una gran cantidad de situaciones de importancia práctica en los que estos cambios son despreciables.
El flujo de un fluido compresible se rige por la primera ley de la termodinámica en los balances de energía y con la segunda ley de la termodinámica, que relaciona la transferencia de calor y la irreversibilidad con la entropía. El flujo es afectado por efectos cinéticos y dinámicos, descritos por las leyes de Newton, en un marco de referencia inercial –aquel donde las leyes de Newton son aplicables-. Además, el flujo cumple con los requerimientos de conservación de masa. Es sabido que muchas propiedades, tales como la velocidad del fluido en un tubo, no son uniformes a lo largo de la corriente.
Presión
La presión (símbolo p) es una magnitud física que mide la proyección de la fuerza en dirección perpendicular por unidad de superficie, y sirve para caracterizar cómo se aplica una determinada fuerza resultante sobre una línea. En el Sistema Internacional de Unidades la presión se mide en una unidad derivada que se denomina pascal (Pa) que es equivalente a una fuerza total de un newton (N) actuando uniformemente en un metro cuadrado (m²). En el Sistema Inglés la presión se mide en libra por pulgada cuadrada (pound per square inch o psi) que es equivalente a una fuerza total de una libra actuando en una pulgada cuadrada.
La presión es la magnitud escalar que relaciona la fuerza con la superficie sobre la cual actúa, es decir, equivale a la fuerza que actúa sobre la superficie. Cuando sobre una superficie plana de área A se aplica una fuerza normal F de manera uniforme, la presión P viene dada de la siguiente forma:
En un caso general donde la fuerza puede tener cualquier dirección y no estar distribuida uniformemente en cada punto la presión se define como:
Donde N es un vector unitario y normal a la superficie en el punto donde se pretende medir la presión. La definición anterior puede escribirse también como:
donde:
En el marco de la teoría cinética la presión de un gas es explicada como el resultado macroscópico de las fuerzas implicadas por las colisiones de las moléculas del gas con las paredes del contenedor. La presión puede definirse por lo tanto haciendo referencia a las propiedades microscópicas del gas:
Para un gas ideal con N moléculas, cada una de masa m y moviéndose con una velocidad aleatoria promedio vrms contenido en un volumen cúbico V las partículas del gas impactan con las paredes del recipiente de una manera que puede calcularse de manera estadística intercambiando momento lineal con las paredes en cada choque y efectuando una fuerza neta por unidad de área que es la presión ejercida por el gas sobre la superficie sólida.
La presión puede calcularse entonces como
Este resultado es interesante y significativo no solo por ofrecer una forma de calcular la presión de un gas sino porque relaciona una variable macroscópica observable, la presión, con la energía cinética promedio por molécula, 1/2 mvrms², que es una magnitud microscópica no observable directamente. Nótese que el producto de la presión por el volumen del recipiente es dos tercios de la energía cinética total de las moléculas de gas contenidas.
Propiedades de la presión en un medio fluido
La fuerza asociada a la presión en un fluido ordinario en reposo se dirige siempre hacia el exterior del fluido, por lo que debido al principio de acción y reacción, resulta en una compresión para el fluido, jamás una tracción.
La superficie libre de un líquido en reposo (y situado en un campo gravitatorio constante) es siempre horizontal. Eso es cierto solo en la superficie de la Tierra y a simple vista, debido a la acción de la gravedad constante. Si no hay acciones gravitatorias, la superficie de un fluido es esférica y, por tanto, no horizontal.
En los fluidos en reposo, un punto cualquiera de una masa líquida está sometida a una presión que es función únicamente de la profundidad a la que se encuentra el punto. Otro punto a la misma profundidad, tendrá la misma presión. A la superficie imaginaria que pasa por ambos puntos se llama superficie equipotencial de presión o superficie isobárica.
Densidad
En física y química, la densidad (del latín densĭtas, -ātis) es una magnitud escalar referida a la cantidad de masa en un determinado volumen de una sustancia. Usualmente se simboliza mediante la letra rho ρ del alfabeto griego. La densidad media es la razón entre la masa de un cuerpo y el volumen que ocupa.
Si un cuerpo no tiene una distribución uniforme de la masa en todos sus puntos la densidad alrededor de un punto puede diferir de la densidad media. Si se considera una sucesión pequeños volúmenes decrecientes \Delta V_k (convergiendo hacia un volumen muy pequeño) y estén centrados alrededor de un punto, siendo \Delta m_k la masa contenida en cada uno de los volúmenes anteriores, la densidad en el punto común a todos esos volúmenes:
La unidad es kg/m³ en el SI.
Como ejemplo, un objeto de plomo es más denso que otro de corcho, con independencia del tamaño y masa.
En un determinado volumen las moléculas de gas ocupan cierto espacio por lo tanto se distribuirán de manera que encontremos menor cantidad en el mismo volumen anterior. Podemos medir la cantidad de materia, ese número de moléculas, mediante una magnitud denominada masa. La cantidad de moléculas, la masa, no varía al aumentar o disminuir (como en este caso) el volumen, lo que cambia es la relación masa - volumen. Esa relación se denomina densidad (d). La densidad es inversamente proporcional al volumen (al aumentar al doble el volumen, manteniendo constante la masa, la densidad disminuye a la mitad) pero directamente proporcional a la masa (si aumentamos al doble la masa, en un mismo volumen, aumenta al doble la densidad).
La materia se puede presentar en sus tres estados (solidó, liquido y gaseoso) en esta ultima se encuentra las sustancias que común mente denominamos gases lo que denominamos gases. Entonces vamos a relación esto con las siguientes leyes.
Miscibilidad
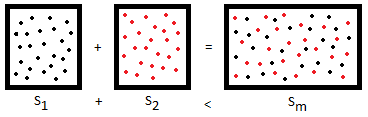
Miscibilidad es un término usado en química que se refiere a la propiedad de algunos líquidos para mezclarse en cualquier proporción, formando una disolución. En principio, el término es también aplicado a otras fases (sólidos, gases), pero se emplea más a menudo para referirse a la solubilidad de un líquido en otro. El agua y el etanol (alcohol etílico), por ejemplo, son miscibles en cualquier proporción.
Por el contrario, se dice que las sustancias son inmiscibles si en alguna proporción no son capaces de formar una fase homogénea. Por ejemplo, el éter etílico es en cierta medida soluble en agua, pero a estos dos solventes no se les considera miscibles dado que no son solubles en todas las proporciones.
La miscibilidad es parcialmente una función de la entropía, y por lo tanto se observa más comúnmente en los estados de la materia que poseen más entropía. Los gases se mezclan con bastante facilidad, pero los sólidos raramente son miscibles. Dos excepciones notables a esta regla son las soluciones sólidas de cobre con níquel (el cuproníquel resultante es usado para la fabricación de monedas y tuberías) , y las de silicio con germanio usadas en electrónica. Las sustancias con entropía configuracional extremadamente baja, los polímeros especialmente, tienen poca probabilidad de ser miscibles entre sí incluso en el estado líquido. Dos sustancias son miscibles si la mezcla tiene como resultado una menor energía libre que cada uno de los componentes por separado.
La miscibilidad de dos materiales con frecuencia se puede determinar ópticamente. Cuando dos líquidos miscibles son combinados, el líquido resultante es claro. Si la mezcla tiene un aspecto turbio entonces los dos materiales son inmiscibles. Se debe tener cuidado al hacer esta determinación. Si el índice de refracción de dos materiales es similar, la mezcla puede lucir clara aunque se trate de una mezcla inmiscible.
En los compuestos orgánicos, el porcentaje del peso de la cadena de hidrocarburos con frecuencia determina la miscibilidad del compuesto con agua. Por ejemplo, entre los alcoholes, el etanol tiene dos átomos de carbono y es miscible con agua, mientras que el 1-octanol (C8H18O) no lo es. Este es también el caso de los lípidos; las largas cadenas que caracterizan a los lípidos son la causa de que estos casi siempre sean inmiscibles con agua. Algo similar ocurre con otros grupos funcionales. El ácido acético es miscible con agua, y en la situación contraria se encuentra el ácido valérico (C4H9CO2H). Los aldehídos simples y las cetonas tienden a ser miscibles con agua, ya que un puente de hidrógeno se puede formar entre el átomo de hidrógeno de una molécula de agua y el par de electrones del átomo de oxígeno carbonilo.








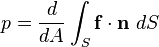



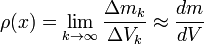

No hay comentarios.:
Publicar un comentario